Científicos de la universidad de Stanford confirman con un ensayo en fase I, cuyos resultados se han publicado en Nature, que estos tratamientos avanzados abren una nueva esperanza contra tumores sólidos con mal pronóstico, como el glioma difuso de línea media, que afectan a niños y jóvenes
Carl June, creador de las terapias CAR-T: “Es poner una patrulla contra el cáncer en la sangre”
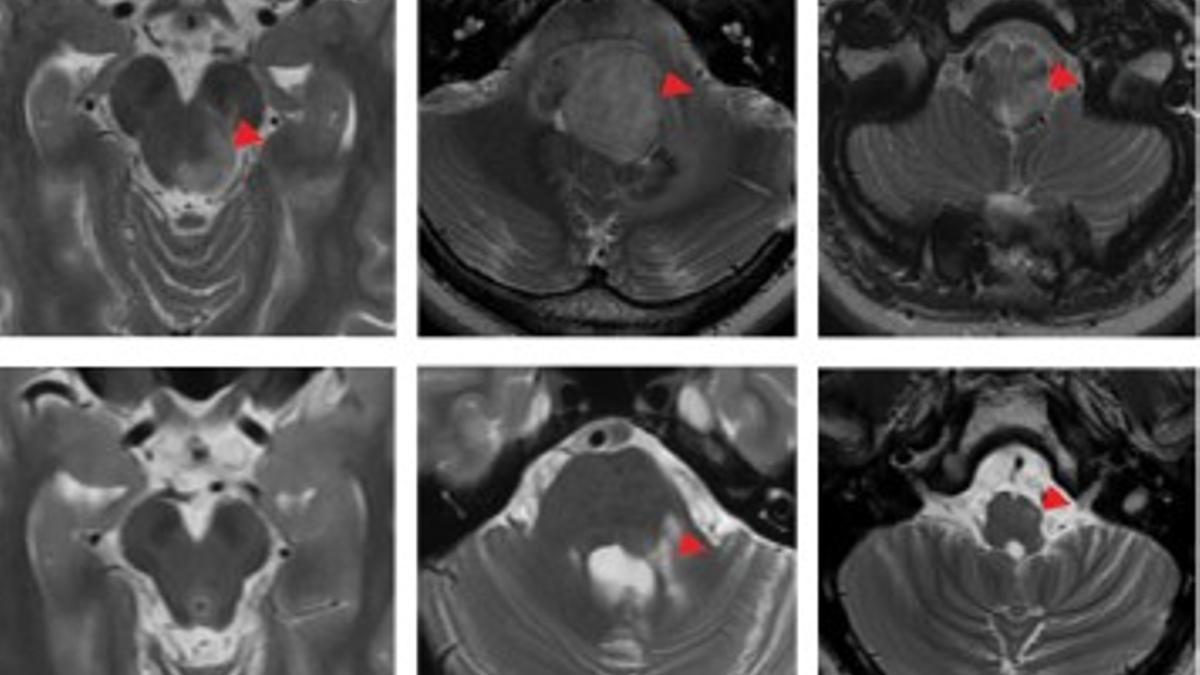
Cada vez hay más estudios que arrojan esperanza sobre la eficacia de las terapias CAR-T en tumores sólidos considerados incurables hasta el momento. Un grupo de científicos de la Universidad de Stanford (Estados Unidos) puso en marcha un ensayo clínico en 2020 con 11 pacientes diagnosticados con glioma difuso de línea medio, un tumor que afecta al sistema nervioso, tiene muy mal pronóstico y aparece en niños y jóvenes. Los resultados, publicados este miércoles en la revista Nature, son alentadores: el tratamiento ha logrado una remisión completa de la enfermedad en uno de ellos, de 17 años. El paciente lleva cuatro años sin patología detectable. Además, el tumor redujo entre un 52 y un 91% su volumen en otros tres casos y en la mayoría se produjo un “beneficio neurológico”, según los investigadores.
El trabajo, lejos de ser definitivo –de momento es un ensayo en fase I– , “es muy prometedor como sugeridor de eficacia”, sostiene Manel Juan, jefe del Servicio de Inmunología del Hospital Clínic de Barcelona, en declaraciones a Science Media Centre. Abre la puerta a cronificar una enfermedad que es incurable a día de hoy a través de un tratamiento que “puede perdurar e integrarse en el organismo al ser un fármaco vivo, al contrario de la quimio o la radioterapia, que solo actúan mientras se aplican”, explica.
Las CAR-T son unas terapias personalizadas que se basan en reprogramar células del sistema inmunitario para que ataquen a las tumorales. Tienen un elevado coste, pero la sanidad pública española está empezando a producirlas en sus propios hospitales a un precio sensiblemente inferior para tratar tumores en la sangre, donde la evidencia de su eficacia es más sólida.
Los expertos reciben los resultados del ensayo estadounidense, que es riguroso y está bien diseñado pese al pequeño volumen de pacientes, como un “auténtico espaldarazo a esta inmunoterapia en términos de seguridad y eficacia”, en palabras de Luis Álvarez-Vallina, jefe de la Unidad de Inmunoterapia del Cáncer del Hospital Universitario 12 de Octubre y del Centro Nacional de Investigaciones Oncológicas.
No obstante, conviene dimensionar la agresividad de este tumor. Aunque se vieron signos de mejora, estos no prevalecieron para la mayoría de los pacientes. El ensayo comenzó con 13 personas: dos de ellas salieron de manera temprana por su rápida evolución de la enfermedad y, 30 meses después de la primera infusión, solo dos de los 11 restantes habían sobrevivido. Tenían de media 15 años.
El glioma difuso de línea medio está asociado a unos síntomas que se redujeron de forma muy importante durante el ensayo. Por ejemplo, el paciente que mejor respondió –hasta el punto de que la enfermedad remitió– tenía “déficits sensoriales y motores” que le obligaban a usar silla de ruedas. Tras recibir el tratamiento, mejoró su coordinación motora “hasta el punto de la independencia”. Otra paciente de 30 años, cuyo tumor menguó un 90% en el mejor momento, tenía antes de la primera infusión, “paraplejia severa, dolor neuropático y disfunción intestinal y vesical”. El dolor mejoró y también la función de las extremidades. Fue capaz de caminar con un bastón.
Pocos casos y muy seleccionados
Uno de los problemas de este tratamiento, como pasa con otros para atacar el cáncer, es la toxicidad. En este estudio se demuestra, coinciden varios expertos, que hay una vía de administración –directamente en el sistema nervioso central– que es menos tóxica y más eficaz. “Lo más interesante del estudio es que la administración locorregional (en la misma zona donde está el tumor de origen) intracavitaria es el camino a seguir. Mediante esta ruta de administración intratumoral se puede optimizar el rendimiento de células CAR-T frente a tumores sólidos con una exposición máxima”, analiza Ignacio Melero, catedrático de Inmunología de la Universidad de Navarra e investigador del CIMA.
El trabajo, con todo, tiene limitaciones. Son pocos casos los tratados y de ellos solo uno logró una respuesta completa a los cuatro años; además, se “seleccionaron mucho los pacientes para que estuvieran en un estado funcional bueno y tumores de un tamaño adecuado”, subraya Marta María Alonso, investigadora del Programa de Tumores Sólidos en el CIMA y la Clínica Universidad de Navarra. Los propios investigadores admiten que todavía es “difícil de discernir si la terapia con células T GD2-CAR impacta favorablemente en la superviviencia general” con una muestra tan pequeño y seleccionada. y “deberá evaluarse en futuros ensayos en fase II”.